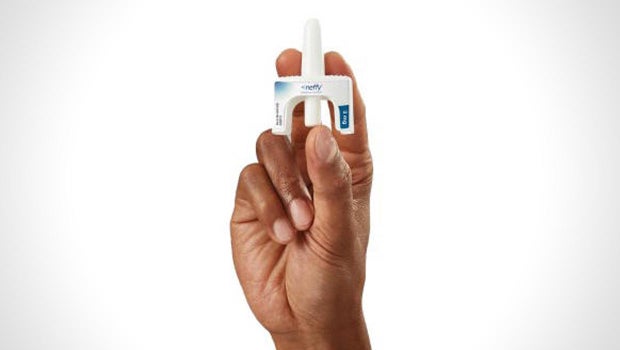
美国食品和药物管理局周二拒绝批准制药商 ARS Pharmaceuticals 生产的肾上腺素鼻喷雾剂 neffy,这使得美国人治疗严重过敏反应的第一个无针选择不再上市,等待更多试验数据。
ARS 原本预计 FDA 会批准奈菲用于体重超过 30 公斤(即 66 磅左右)的成人和儿童。 这种喷雾剂需要处方,类似于目前用于治疗过敏反应的 EpiPens 和其他肾上腺素注射剂。
肾上腺素在紧急情况下对于治疗可能危及生命的过敏反应至关重要。 这种新的喷雾剂如果最终获得批准,将为许多有严重过敏症的儿童的家庭提供一个受欢迎的替代方案,他们宁愿避免打针。
ARS制药公司
据 ARS 报道,FDA 监管机构周二决定,需要更多数据来评估重复剂量鼻喷雾剂的安全性,然后才能获得批准。 FDA 顾问在 5 月份发布的先前指南中曾建议,可以在药物上市后的试验中收集额外的数据,因此制药商对周二的决定表示失望。
“我们对这一行动和此时将重复剂量研究从上市后要求(我们之前与 FDA 一致)改为预先批准要求感到非常惊讶,特别是考虑到积极的建议委员会投票,”ARS Pharma 联合创始人、总裁兼首席执行官理查德·洛文塔尔 (Richard Lowenthal) 在周二晚间的一份声明中表示。 “我们对这一行动进一步推迟了可用性深感失望 内菲 为数百万面临可能危及生命的严重过敏反应风险的人提供帮助。 患者和护理人员正在等待 内菲,我们的目标是尽快完成新要求的试验,以满足患者的需求。”
Lowenthal 对 FDA 外部顾问小组表示:“主要障碍限制了肾上腺素在社区环境中的快速使用。许多患者害怕针头,许多患者对自行注射感到不舒服。携带当前可用的设备也很不切实际。”在五月份的一次会议上权衡该产品。
洛文塔尔告诉委员会,该公司计划将产品装在一个“细长的奈菲手提箱”中,每个手提箱装有两个喷雾器。
Lowenthal 表示,他们的调查显示,如果可以选择奈菲,多达 85% 的严重过敏患者愿意每天随身携带肾上腺素,而目前选择的这一比例约为 55%。
“如果他们没有随身携带,那就没有意义了。他们不分娩,他们没有药物,他们会去医院,”洛文塔尔五月份说。
该制药商表示,neffy 鼻喷雾剂的工作原理是使用 FDA 批准的其他产品中已经使用的另外两种技术,向面临过敏发作的患者提供一定剂量的肾上腺素。 其中一种是十二烷基麦芽糖苷,由制药商 Neurelis 许可,该物质称其可通过粘膜“增强药物吸收”,粘膜是从鼻子到肺部的气道细胞。 Neurelis 在自己的喷雾剂中使用了这种名为 Intravail 的成分来治疗癫痫。
另一种是 Aptar Pharma 销售的喷雾器装置,已在多种产品中使用。 它与 Narcan 牌纳洛酮鼻喷雾剂使用的喷雾器类型相同,纳洛酮鼻喷雾剂用于治疗药物过量,最近获得 FDA 批准在非处方药销售。
尽管有一些非专利替代品可供使用,但一些美国人仍然面临着每年购买现有肾上腺素注射装置的高昂价格。 品牌 EpiPen 及其非专利替代品可能会让一些家庭每年花费超过 200 美元,这导致一些州探索肾上腺素价格上限。
更多肾上腺素鼻喷雾剂也在研发中。 制药商 Bryn Pharma 吹捧其实验性肾上腺素鼻喷雾剂 Utuly 的可喜成果,称其性能可能优于现有注射器。
和注射一样有效吗?
FDA 在等待更多试验数据之前拒绝了 neffy,这只是 ARS 将该药物推向市场的最新一次延迟。
该公司此前曾表示 FDA 可能会在 2023 年中期之前决定批准 neffy。 但 ARS 在 6 月份透露,FDA 已告知该公司需要在 9 月份之前做出批准决定。 该公司表示,需要额外的时间来完成 FDA 咨询委员会关于纳菲的会议后提出的“标签和上市后承诺讨论”。
FDA 肺部过敏药物咨询委员会的大多数成员最终在 5 月份投票支持奈菲的益处大于其风险,此前他们就该喷雾剂是否不如目前的注射剂有效等一系列问题进行了思考。
Lowenthal 在一份新闻稿中表示:“在 5 月份的 PADAC 会议上对我们的 neffy 临床数据进行了强烈认可后,解决任何最终问题和完成标签的时间有限。”
虽然专家们普遍认为肾上腺素可以有效治疗严重过敏反应,但这种化学物质(纯化的肾上腺素的历史可以追溯到 20 世纪初)的使用早于 FDA 的存在。 这意味着肾上腺素最初用于治疗过敏反应时没有进行临床试验来直接证明它的作用,也没有更好地了解药物在体内需要进行哪些测量才能发挥作用。
FDA 表示,最初的 EpiPen 于 1987 年获得批准,没有进行临床试验,也没有关于药物如何吸收或其对身体影响的详细数据。
FDA 官员承认,要证明肾上腺素喷雾剂和注射剂一样有效的临床试验很难在道德上进行。
相反,ARS Pharmaceuticals 进行了各种研究来生成所谓的“替代”数据,旨在弄清楚其喷雾剂是否可能与注射剂一样有效。
其中包括对暴露于季节性过敏原的受试者进行给药,以及测量体内药物的浓度,这产生了一些相互矛盾的数据。 与肾上腺素注射测量结果的比较也导致了不同的结果。
“我真的希望这个产品发挥作用。我的意思是,我们肯定会从无针递送外延的方式中受益。而且我认为赞助商在试图找到这种平衡方面做得很好。也就是说,我认为我们正在使用FDA 委员会成员刘易斯·纳尔逊 (Lewis Nelson) 在 5 月份的会议上表示:
Nelson 与其他委员会成员一样,赞扬该公司和 FDA 解决其他肾上腺素注射液中出现的一些重大差异的方法。 但他也表示,他认为需要更多数据才能批准该药物。
他在会议上表示:“我真的不愿意得知,在没有更好的临床数据的情况下,我们建议根据替代数据批准一种产品,这些数据不一致且有些令人困惑,最终使患者受到伤害。”